Contoh larutan penyangga banyak kita temukan dalam kehidupan sehari-hari. Walaupun mungkin tidak familiar bagi sebagian orang, larutan penyangga atau buffer ternyata memberikan beragam manfaat penting dalam kehidupan keseharian kita. Larutan buffer sendiri merupakan materi kimia yang terdapat di kelas 11.
Baca juga: pH Larutan Penyangga Jenis Asam dan Basa yang Sebenarnya!
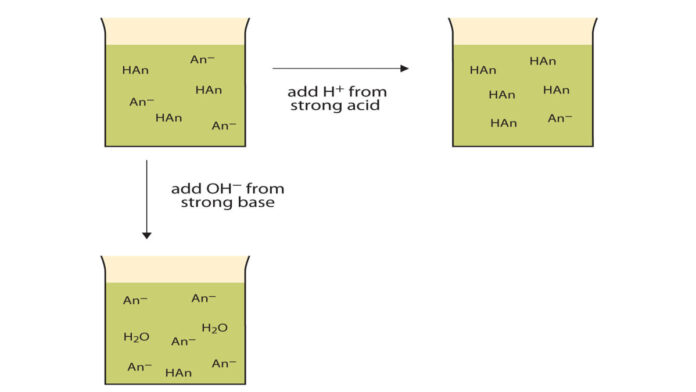
Larutan buffer merupakan tipe larutan yang mampu memelihara pH tetap stabil bahkan ketika ada penambahan asam atau basa. Komposisi larutan ini melibatkan asam lemah atau basa lemah beserta garam sebagai hasil dari interaksi keduanya.
Penerapan larutan buffer ini sangat vital dalam beragam sektor industri. Mulai dari produksi makanan, farmasi, dan proses pemurnian air.
Contoh Larutan Penyangga dalam Kehidupan
Larutan buffer ini merupakan solusi yang menjaga stabilitas pH atau tingkat keasaman larutan. Dalam buffer ini, pH tetap konstan bahkan jika air kita tambahkan.
Proses ini menghasilkan perubahan pH yang minimal atau tidak signifikan ketika asam atau basa kita tambahkan. Karakteristiknya memberikan kontribusi penting terhadap regulasi pH dalam tubuh manusia.
Ini memungkinkan tubuh untuk mempertahankan pH yang optimal meskipun terpapar dengan zat asam atau basa. Stabilnya tingkat keasaman memungkinkan tubuh untuk menjalankan fungsi-fungsinya dengan efektif dan menghindari risiko penyakit.
Baca juga: Manfaat Larutan Penyangga di Dalam Kehidupan Sehari-Hari, Ini Dia!
Dari penjelasan di atas, kita dapat menyimpulkan bahwa larutan buffer memiliki kemampuan untuk menjaga pH tetap stabil terhadap perubahan yang berasal dari penambahan asam, basa, atau pengenceran. Sehingga, pH larutan penyangga tidak akan berubah bahkan jika terdapat penambahan asam kuat, basa kuat, atau kita lakukan pengenceran.
Rumus
Rumus dasar larutan penyangga adalah:
pH = pKa + log [A-] / [HA]
Di mana:
- • pH adalah nilai pH larutan penyangga
- • pKa adalah konstanta asam dari zat asam lemah dalam larutan
- • [A-] adalah konsentrasi basa konjugat dalam larutan
- • [HA] adalah konsentrasi asam lemah dalam larutan
Rumus ini menggambarkan kekuatan asam lemah dan pasangan asam-basa konjugat dalam larutan. Dengan konsentrasi yang tepat, larutan penyangga mampu menjaga pH stabil.
Selain itu, rumus tersebut juga berguna untuk menghitung pH larutan buffer saat terjadi penambahan asam/basa atau perubahan konsentrasi. Penting juga memahami rumus lain terkait larutan jenis ini.
Seperti kapasitas penyangga dan perubahan pH akibat penambahan asam atau basa. Pengetahuan ini krusial dalam pembuatan dan penggunaan larutan penyangga yang efektif.
Prinsip Kerja
Sebelum mengetahui apa saja contoh larutan penyangga dalam kehidupan, sebaiknya kita juga memahami prinsip kerjanya. Larutan buffer bekerja melalui keseimbangan antara asam lemah dan basa kuat, atau basa lemah dan asam kuat.
Saat asam atau basa kita tambahkan ke dalamnya, konsentrasi ion hidrogen (H+) tetap stabil karena terjadi reaksi antara asam atau basa dengan garam dalam larutan. Misalnya:
Asam lemah + basa kuat –> garam + air Basa lemah + asam kuat –> garam + air
Contoh pada larutan penyangga asam: CH3COOH + NaOH –> CH3COONa + H2O
Contoh pada larutan penyangga basa: NH3 + HCl –> NH4Cl + H2O
Penerapan Larutan Buffer di Kehidupan
Contoh larutan penyangga pertama yaitu larutan pembersih untuk lensa kontak. Larutan ini disesuaikan dengan pH mata, mengandung borat untuk perawatan lensa kontak yang membantu mengatasi gangguan penglihatan.
Selain itu, dalam industri pengalengan, terdapat penambahan asam sitrat dan natrium sitrat pada buah yang dikalengkan. Hal tersebut bertujuan untuk menjaga pH agar tidak terganggu oleh aktivitas bakteri.
Baca juga: Kesetimbangan Asam Basa dalam Kimia Dasar
Industri farmasi memanfaatkan larutan buffer dalam pembuatan obat suntik dan tetes mata demi mempertahankan khasiat obat dari perubahan derajat keasaman. Larutan penyangga juga bisa kita temukan dalam sampo untuk menjaga pH sesuai dengan rentang 4,6 – 6,0 agar tidak merusak rambut.
Dalam pengolahan limbah industri, prinsip kerja larutan penyangga dapat kita manfaatkan untuk mengatur pH limbah agar stabil pada kisaran 5-7,5. Hal ini memungkinkan pemisahan materi organik dari limbah dan pembuangan yang aman.
Sehingga sesuai dengan prinsip kimia yang terpapar dalam buku “Belajar Kimia Secara Menarik XI untuk SMA/MA Kelas XI” oleh Das Salirawat dkk (2007:258).
Bahkan dalam darah manusia terdapat tiga larutan buffer yang penting. Ada larutan penyangga karbonat, hemoglobin, dan fosfat. Ketiganya berperan dalam menjaga pH darah agar tetap stabil. Sehingga memungkinkan darah berfungsi optimal dalam sistem metabolisme tubuh.
Baca juga: Sifat Senyawa Asam, Salah Satunya dari Indikator Kertas Lakmus
Nah, demikian tadi adalah beberapa contoh larutan penyangga di sekitar kita. Namun, penting untuk memperhatikan penggunaan larutan buffer karena memiliki kapasitas terbatas dalam menetralkan asam atau basa. Oleh karena itu, penggunaannya harus kita sesuaikan dengan kebutuhan yang ada. (R10/HR-Online)