Perbedaan sel volta dan sel elektrolisis cukup penting. Anda tentu harus memahami perbedaan dari sel volta dan juga elektrolisis. Apabila Anda mempelajari kimia, maka kedua sel ini merupakan hal yang wajib diketahui.
Keberadaan dari kedua sel memiliki fungsi yang sangat penting, terutama di dalam sel elektrokimia. Baik volta maupun elektrolisis merupakan dua jenis sel elektrokimia.
Meski keduanya termasuk ke dalam jenis sel elektrokimia, tetapi ada perbedaan yang cukup besar. Pastinya perbedaan ini perlu Anda pahami agar tidak salah mengartikannya.
Baca Juga: Ciri Khas Atom Karbon yang Istimewa, Apa Saja Itu?
Apa Perbedaan Sel Volta dan Sel Elektrolisis?
Sel elektrokimia merupakan suatu alat yang berguna untuk mengubah energi kimia yang muncul dari dalam reaksi redoks kemudian berubah menjadi listrik.
Setiap setengah dari sel elektrokimia ini akan terdiri atas batang logam yang masuk ke dalam larutan berasal dari ionnya sendiri. Selanjutnya, reaksi reduksi oksidasi atau yang terkenal sebagai reaksi redoks kemudian akan berlangsung di dalam sel elektrokimia.
Sel elektrokimia sendiri terbagi menjadi dua, yaitu volta dan elektrolisis. Keduanya memiliki perbedaan jenis maupun ciri.
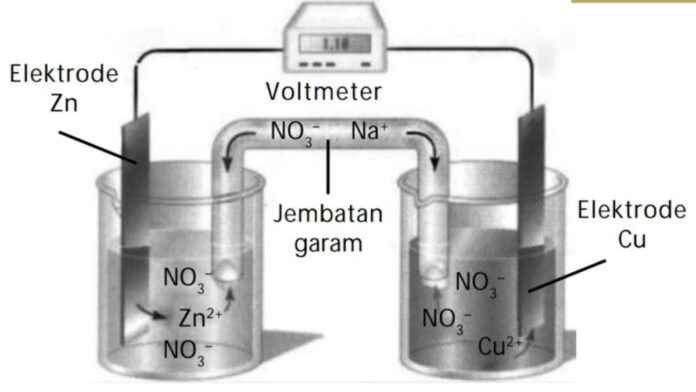
Volta merupakan sel yang merupakan hasil temuan dari ilmuwan asal Italia, yaitu Alessandro Volta dan Luigi Galvani. Tidak heran jika sel volta juga memiliki nama sel galvani.
Sel volta merupakan jenis sel elektrokimia yang dapat mengubah energi kimia menjadi listrik, misalnya seperti baterai.
Sementara itu, sel elektrolisis merupakan sel elektrokimia yang dapat mengubah listrik menjadi energi kimia melalui penguraian senyawa elektrolit, contohnya seperti pada penyepuhan emas.
Terdapat perbedaan sel volta dan sel elektrolisis. Apa saja itu?
Baca Juga: Senyawa Kovalen Polar: Pengertian, Sifat, Ciri Beserta Contohnya
Perbedaan dari Kedua Jenis Sel Elektrokimia
Ada beberapa perbedaan mendasar antara volta dan elektrolisis. Berikut ini perbedaannya:
- Volta memiliki anoda yang bermuatan negatif dan katoda positif. Sementara itu, elektrolisis memiliki anoda positif dan negatif pada katodanya.
- Reaksi pada sel volta berjalan spontan tanpa adanya energi dari luar dan murni berasal dari peristiwa redoks. Sedangkan reaksi pada sel elektrolisis tidak spontan dan membutuhkan energi listrik dari luar.
- Perbedaan selanjutnya adalah volta memiliki jembatan garam untuk menjaga cairan elektrolit agar tetap netral, tetapi elektrolisis tidak memiliki jembatan garam.
- Sel volta memiliki potensial sel standar positif, sedangkan sel lainnya memiliki standar negatif.
- Keduanya memiliki jenis perubahan energi yang berbeda.
Penerapan Sel Volta
Setelah Anda memahami apa saja perbedaan sel volta dan elektrolisis, maka akan lebih mudah dalam memahami penerapannya.
Sel volta menciptakan reaksi redoks yang merupakan reaksi spontan. Alasan terjadinya hal tersebut karena sel volta sering menjadi baterai.
Reaksi sel volta yang memasok energi tersebut bermanfaat untuk melakukan kerja atau usaha. Energi yang muncul akhirnya akan berfungsi dan menempatkan oksidasi serta reduksi pada wadah terpisah.
Alhasil, perbedaan keduanya memberikan kemungkinan elektron mengalir. Sel volta sendiri merupakan sel Daniell.
Baca Juga: Simbol Bahan Kimia Berbahaya yang Merugikan, Harus Waspada!
Penerapan Sel Elektrolisis
Pastinya untuk penerapan sel elektrolisis ini juga berbeda dari sel sebelumnya. Di dalam elektrolisasi ini terjadi reaksi redoks tidak spontan karena membutuhkan reaksi listrik untuk memancing reaksi elektrolisis.
Contoh dari sel elektrolisis yang paling mudah kita jumpai adalah penguraian garam menjadi unsur pembentuk atau terkenal sebagai NaCl cair.
Elektrolisis NaCl cair tersebut kemudian akan membentuk natrium cair dan gas klorin. Ion-ion natrium tersebut akan berpindah menuju arah katodan dan mengalami reduksi menjadi logam natrium.
Hal yang sama terjadi pada ion klorida, muatan tersebut akan berpindah menuju anoda dan kemudian mengalami oksidasi sehingga membentuk gas klor.
Jenis sel tersebut bermanfaat dalam proses produksi natrium dan juga klorin. Pada kenyataannya, gas klorin sendiri dapat berkumpul di sekitar sel.
Logam natrium yang kurang daripada garam cair, sehingga akan hilang seperti menghaping ke bagian atas dari wadah reaksi.
Sel elektrolisis ini dapat kita temukan di perangkat mana saja, misalnya seperti baterai HP yang sedang mengisi daya.
Memahami perbedaan sel volta dan sel elektrolisis merupakan hal yang perlu Anda lakukan. Dengan begitu, maka Anda bisa lebih mudah memahami apa sebenarnya kedua sel tersebut. (R10/HR-Online)