Rumus konsep mol dan stoikiometri sangat penting dipakai dalam menghitung reaksi kimia. Kedua konsep ini adalah dasar penting yang merupakan bagian materi pelajaran Kimia, kelas 10 atau 1 SMA.
Baca Juga: Manfaat Kalium Klorida dan Dosis Penggunaan yang Tepat
Dalam ilmu kimia, konsep mol berfungsi untuk menghitung jumlah partikel di dalam suatu zat. Sedangkan stoikiometri mempelajari tentang hubungan kuantitatif yang terjadi pada reaktan dengan produk di dalam reaksi kimia.
Rumus Konsep Mol dan Stoikiometri dalam Kimia
Penggunaan konsep mol dan stoikiometri penting di dalam berbagai penerapan kimia, termasuk analisis, sintetis, maupun industri kimia. Melansir buku karya Nana Sutresna, dkk (2008:2) berjudul Persiapan Ujian Nasional Kimia, stoikiometri adalah perhitungan dalam reaksi kimia.
Namun, untuk bisa mengerti perhitungan ini, perlu memahami juga konsep mol yang ada dalam kimia. Bisa kita sebut, antara konsep mol dengan stoikiometri memiliki keterkaitan dalam kimia.
Konsep Mol
Mol adalah satuan dasar dalam sistem SI yang dipakai untuk menghitung jumlah partikel dalam suatu zat. Partikel ini meliputi atom, molekul, ion, dan lainnya. Satu mol suatu zat mengandung jumlah partikel yang sama dengan jumlah atom dalam 12 gram karbon-12 (C-12).
Definisi lainnya, satu mol setara dengan jumlah zat yang mengandung partikel sebanyak bilangan Avogadro. Tetapan Avogadro sendiri adalah 6.022 x 10^23 partikel dalam satu mol zat.
Mol umumnya berfungsi untuk menghitung jumlah partikel dalam reaksi kimia dan untuk mengonversi antara massa zat dan jumlah partikel. Rumus konsep mol dan stoikiometri akan lebih mudah Anda pahami dengan mengetahui beberapa hal penting terkait mol di bawah ini.
1. Massa Molar
Massa molar ialah massa satu mol zat yang nilainya sama dengan Ar (massa atom relatif) pada atom dan Mr (massa molekul relatif) pada senyawa. Pernyataan rumus untuk massa molar adalah dalam bentuk gram per mol (g/mol). Hubungan massa dengan jumlah mol zat bisa dinyatakan sebagai berikut:
Massa (gram) = jumlah mol x massa molar (gr/mol)
Massa molar = Ar atau Mr (gram/mol)
Berikut adalah gambar perumusan massa molar secara sistematis:
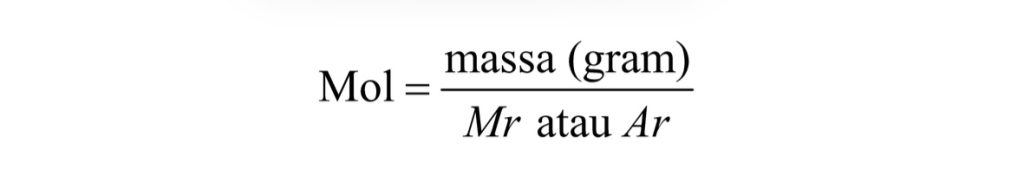
2. Volume Molar
Volume molar merupakan volume satu mol suatu gas. Ini merepresentasikan volume 1 mol gas pada tekanan dan suhu tertentu.
Pada kondisi Standard Temperature and Pressure (STP), 1 mol gas mempunyai volume 22,4 liter. Sedangkan dalam kondisi room Temperature and Pressure (RTP) 1 gas mol mempunyai volume 24 liter.
Baca Juga: Memahami Reaksi Orde Satu dalam Kinetika Reaksi Kimia
Untuk memahami rumus konsep mol dan stoikiometri lebih lanjut, pahami hubungan antara volume dengan jumlah mol gas pada kondisi STP berikut.
Jumlah mol = (Volume gas)/(22,4 (L/mol))
3. Perhitungan dengan Mol
Jumlah mol (n) = Massa zat (m) / Massa molar (M)
Jumlah partikel = Jumlah mol (n) x Bilangan Avogadro (NA)
Stoikiometri
Beralih ke definisi stoikiometri yang berasal dari bahasa Yunani “stoicheion” artinya mengukur. Stoikiometri merupakan cabang ilmu kimia yang mempelajari tentang kuantitas suatu zat dalam reaksi kimia.
Zat-zat ini mencakup jumlah partikel, jumlah, mol, volume, dan massa. Dalam pengertian lain, stoikiometri ialah perhitungan kimia seputar hubungan kuantitatif zat yang terlibat dalam reaksi.
Dalam menggunakan rumus konsep mol dan stoikiometri, suatu reaksi kimia baru bisa disebut reaksi stoikiometri bilamana reaktan dalam reaksi habis seluruhnya. Berikut adalah rumus-rumus dalam materi stoikiometri:

Penjelasan:
Angka 22,4 L adalah volume gas ideal dalam kondisi STP dengan suhu (T) = 273 K dan tekanan gas (P) = 1 atm
Angka 6,02 x 1023 adalah Avogadro. Artinya, satu mol zat apapun mempunyai jumlah partikel yang sama, yaitu sejumlah 6,02 x 1023 partikel.
Keterkaitan Konsep Mol dengan Stoikiometri
Kegunaan stoikiometri dalam menentukan jumlah zat tidak terpisahkan dari konsep mol. Penerapan konsep mol dan stoikiometri membantu menentukan proporsi molar dari reaktan dan produk. Di samping itu, kedua konsep ini juga berguna dalam menghitung jumlah zat yang diperlukan di dalam suatu reaksi.
Baca Juga: Konfigurasi Elektron Berdasarkan Kulit dalam Ilmu Kimia
Rumus konsep mol dan stoikiometri merupakan dasar dalam perhitungan kuantitatif bidang kimia. Keduanya memungkinkan kita memprediksi sekaligus memahami jumlah zat yang terlibat dalam reaksi kimia. (R10/HR-Online)







