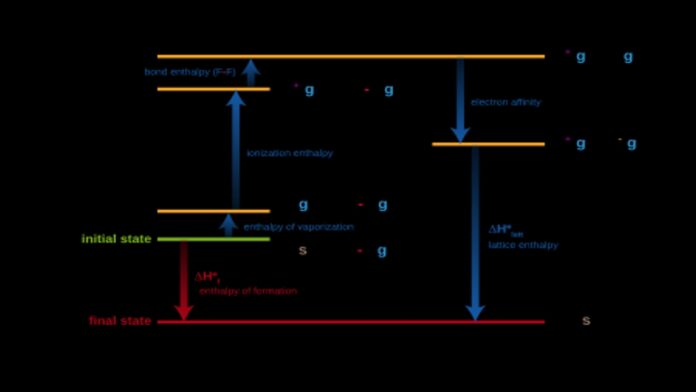
Perubahan entalpi pembentukan standar menjadi salah satu hal penting untuk memahami termokimia. Namun dalam termokimia, entalpi tidak bisa dihitung secara pasti. Karena yang dapat dihitung adalah entalpi ΔH, yakni sudah menyertai adanya reaksi kimia. Saat reaksi kimia terjadi, bersamaan dengan penyerapan atau pelepasan kalor.
Baca juga: Persamaan Reaksi Kimia, Syarat dan Wujud Zatnya
Sebenarnya hal ini terjadi dalam kehidupan sehari-hari, hanya saja tanpa kita sadari. Dalam reaksi kimia, entalpi merupakan selisih akhir dengan awal.
Kemudian mempunyai tekanan 1 atm dan pengukuran suhu 298 K. Simbolnya adalah H atau Heat dengan entalpi akhir yang merupakan entalpi produk dan entalpi awal merupakan reaktan.
Perubahan Entalpi Pembentukan Standar dalam Reaksi Kimia
Pengertian dari perubahan entalpi pembentukan standar merupakan perubahan reaksi 1 mol zat keadaannya standar 25 derajat, tekanan 1 atm. Sehingga satuannya adalah kj/mol.
Definisi dari perubahan perubahan entalpi pembentukan standar mempunyai perbedaan dengan perubahan entalpi. Karena perubahan entalpi ketika reaksi kimia terjadi jumlahnya bebas atau sistem serap.
Simbolnya adalah ΔHfθ atau ΔfHθ yang mengindikasikan dalam babak tersebut terjadi hanya saat kondisi standar. Artinya, jika terjadi pada gas, kondisi standar lebih tepat ketika 1 bar.
Berbeda lagi untuk substansi sebuah larutan, maka konsentrasinya tepat 1 M pada tekanan 1 bar. Sementara substansi murni kondisi yang terkondensasi, pada tekanan 1 bar baik air maupun padatan murni.
Baca juga: Reaksi Eksoterm dan Endoterm, Ini Pengertian dan Ciri-cirinya
Untuk perubahan standar elemen kimia tekanan 1 bar paling stabil, namun pada suhu tertentu. Misalnya saja pada karbon dioksida, entalpi tertulis 1 mol produk sudah terbentuk saat kondisi standar. Standarnya untuk semua entalpi pembentukan, C (s,grafit) + O2(g) → CO2(g).
Sementara termokimia merupakan ilmu yang mempelajari tentang perubahan panas atau kalor suatu zat. Dalam hal ini melibatkan proses kimia dan fisika.
Persamaan termokimia ini penting untuk menginformasikan reaksi tersebut. Apalagi berhubungan dengan jumlah mol reaktan, energi dan produk.
Maka harus senantiasa memperhatikan fase zat dan penulisan koefisien, karena berpengaruh terhadap perubahan entalpi.
Jenis Perubahan Entalpi
Perubahan entalpi pembentukan standar terbagi menjadi beberapa macam. Pertama ada ∆Hc atau entalpi pembakaran standar, yang terjadi ketika 1 mol dapat terbakar dengan sempurna.
Baca juga: Cara Menentukan Orde Reaksi, Grafik, Logika dan Komparatif
Sebagai contoh persamaan termokimia berikut C2H6(g)+3 ½ O2(g) → 2CO2(g)+3H2O(g) ∆H = -2803 kJ.
Untuk yang kedua mempunyai ∆Hf dan terbentuk saat keadaan standar 1 mol senyawa. Contohnya pada pembentukan H2O, jadi H2(g)+½ O2(g) → H2O(l) ∆H = -285,9 kJ. Kesimpulannya, dalam pembentukan 1 mol H@O dari O2 dan H2 maka energi yang dibutuhkan -285,9 kJ.
Tidak hanya itu saja, ada peleburan (∆Hfus) dan pelarutan (∆Hcl). Peleburan standar, perubahan 1 mol pada titik lebur dan tekanan yang standar menjadi cair. H2O(s) → H2O(l) ∆H=+6,01 kJ terjadi pada reaksi peleburan termokimia.
Sementara itu, ∆Hvap atau entalpi penguapan standar terjadi jika 1 mol pada zat cair berubah menjadi zat gas. Hal tersebut terjadi saat tekanan dan titik didihnya standar. Persamaannya H2O(l) → H2O(g) ∆H=+44,05kJ.
Terdapat pula ∆Ha atau entalpi pembentukan standar pengatoman senyawa. Perubahan entalpi ini terjadi saat 1 mol atom berbentuk gas.
Entalpi ini terbentuk dari senyawa ketika kondisinya standar dan berbentuk fisik. Untuk persamaannya adalah CH4(g) → C(g)+4H(g) ∆H =+1662 kJ.
Untuk pelarutan standar, akan terjadi perubahan saat dalam 1 mol zat kemudian berubah menjadi larutan. Perumpamaannya yakni sebagai berikut, NaOH(s) → NaOH(aq) ∆H=+50 kJ pada persamaan termokimia.
Kunci dalam Menghitung
Terdapat beberapa hal yang perlu diperhatikan untuk memudahkan perhitungan pembentukan entalpi perubahan standar. Saat membalik reaksinya, maka besar ΔH sama. Dalam hal ini yang berubah hanyalah tandanya, yang semula negatif menjadi positif dan sebaliknya.
Kemudian sebuah reaksi yang setara, maka kalikan dengan bilangan pengali. Untuk besaran ΔH, kalikan juga dengan bilangan yang sama dengan pengali.
Perubahan entalpi reaksi mudah untuk menghitungnya. Tinggal menambahkan antara produk dengan entalpi pembentukan reaktan.
Sementara itu, dalam kalkulasi entalpi tidak menyertakan elemen pada kondisi standar. Sebab, elemen tersebut kondisi standarnya adalah nol.
Baca juga: Konsep Reaksi Redoks: Reaksi Elektron, Oksigen, dan Fungsinya
Perubahan entalpi pembentukan standar pengukurannya menggunakan energi persatuan unit substansi. Satuannya menggunakan kilo joule per mol (kJ mol−1), namun bisa juga mengukur satuan kalori per mol, kilo kalori per mol atau joule per mol. Jadi, entalpi bernilai positif jika menerima energi, negatif apabila melepas energi dan bernilai nol apabila unsur tersebut secara alami sudah terdapat di alam. (R10/HR-Online)