Teori kesetimbangan kelarutan di dalam senyawa kimia. Kesetimbangan kelarutan memiliki teori yang cukup penting. Anda perlu memahami materi kimia satu ini.
Senyawa menjadi suatu unsur penting yang ada di dalam materi kimia. Suatu senyawa kimia dapat mengalami kesetimbangan kelarutan.
Baca Juga: Pengertian Entalpi Reaksi Kimia, Definisi, Rumus, dan Jenisnya
Terdapat teori yang membahas peristiwa ini. Bahkan materi ini ada di bangku sekolah. Ada banyak soal-soal ujian sekolah kimia mengenai kesetimbangan kelarutan ini.
Teori Kesetimbangan Kelarutan pada Senyawa
Di dalam kehidupan, kelarutan menjadi peristiwa yang sangat penting. Manfaat dari peristiwa kelarutan ini seperti ketika memasak makanan.
Anda akan membumbui masakan dengan rempah-rempah pilihan. Rasa lezat yang muncul pada makanan tersebut karena rempah dan bumbu di dalamnya larut.
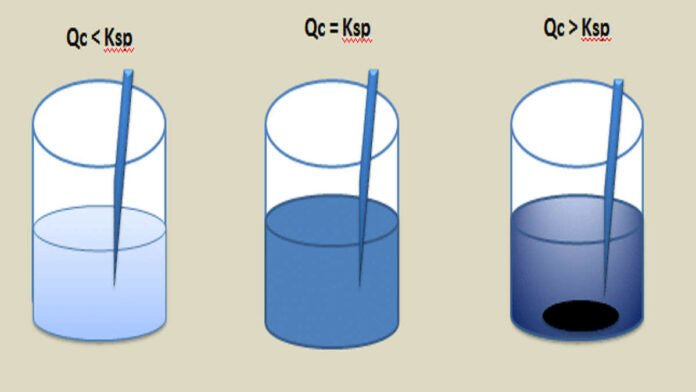
Di dalam ilmu kimia, ada kesetimbangan kelarutan. Ini merupakan suatu jenis kesetimbangan dinamis dan dapat terjadi apabila senyawa kimia yang padat berada di dalam kesetimbangan kimia bersama larutannya.
Suatu padatan bisa terlarut tanpa adanya perubahan. Padatan tersebut dapat terlarut melalui cara disosiasi atau reaksi kimia dan konstituen lainnya, seperti asam basa.
Setiap jenis kesetimbangan memiliki ciri konstanta kesetimbangan yang bergantung dengan suhu. Kesetimbangan kelarutan ini sangat penting dalam skenario farmasi, lalu lingkungan dan segala aspek lainnya.
Apa yang Dimaksud dengan Kesetimbangan Kelarutan?
Mungkin untuk orang awam masih asing dengan kesetimbangan kelarutan ini. Namun begitu, sebenarnya kesetimbangan kelarutan adalah suatu materi yang ada di dalam kimia.
Teori kesetimbangan kelarutan dapat terjadi ketika senyawa kimia yang ada pada keadaan padat menuju kesetimbangan dengan larutan senyawa itu sendiri.
Hal itu termasuk salah satu contoh kesetimbangan dinamis. Artinya, kesetimbangan terjadi karena beberapa molekul individu bergerak dari fase padat dan larutan.
Baca Juga: Titrasi Asam Basa Larutan: Definisi, Hasil, dan Juga Kedua Jenisnya!
Sehingga, laju dari pelarutan dan juga pengendapan akan setimbang atau sama satu dengan yang lainnya.
Ketika kesetimbangan ini tercapai, artinya larutan tersebut adalah jenuh. Konsentrasi dari zat terlarut di dalam larutan jenuh tersebut kemudian terkenal sebagai kelarutan.
Satuan Kesetimbangan Kelarutan
Dalam memahami teori kesetimbangan kelarutan, akan lebih mudah jika Anda mengetahui lambang atau satuannya. Sebab, Anda akan banyak menemukan satuan ini.
Satuan dari kelarutan sebenarnya dapat dinyatakan ke dalam molar (mol•dm−3 atau mol•L−1). Selain itu, satuan molar juga dapat kita jadikan sebagai massa per satuan volume, misalnya seperti μg•mL−1.
Kelarutan akan bergantung dengan suhu yang ada di sekitarnya. Larutan dengan kandungan konsentrasi zat terlarut yang lebih tinggi daripada kelarutannya dapat menjadi superjenuh.
Ketika telah menjadi superjenuh, maka larutan tersebut dapat melalui tahap induksi agar bisa mencapai teori kesetimbangan larutan.
Proses mencapai kesetimbangan larutan pada superjenuh adalah dengan penambahan “benih” yang kemungkinan berupa kristal berukuran mungil dari zat terlarut atau suatu partikel padat kecil yang menginisiasi pengendapan.
Tipe-Tipe Kesetimbangan Kelarutan
Tentunya teori kesetimbangan kelarutan yang terjadi memiliki tiga tipe utama. Berikut ini tipe-tipe dari kesetimbangan kelarutan tersebut:
- Disolusi atau pelarutan sederhana pada suatu larutan.
- Disolusi yang bersamaan dengan disosiasi yang termasuk ciri khas garam.
- Konstanta kesetimbangan pada hal ini terkenal sebagai produk kesehatan.
- Pelarutan dengan reaksi yang terjadi. Tipe teori kesetimbangan pelarutan ini adalah asam lemah atau basa lemah yang ada di media berair dengan berbagai pH.
Di dalam setiap kasus kelarutan, konstanta dari kesetimbangannya dapat kita tentukan sebagai kuosien aktivitas.
Konstanta kesetimbangan tersebut mengalami nirdimensi akibat dari aktivitas dan menjadi kuantitas tanpa adanya dimensi.
Meski begitu, penggunaan dari aktivitas sangatlah merepotkan hingga konstanta kesetimbangan umumnya akan terbagi dengan kuosien koefisien aktivitas agar bisa menjadi kuosien konsentrasi.
Baca Juga: Ciri Larutan Basa di Dalam Kimia dan Contohnya pada Kehidupan
Selain hal tersebut, konsentrasi dari pelarut umumnya dapat kita anggap konstan dan telah masuk ke dalam konstanta kesetimbangan.
Untuk yang satu ini, konstanta dari kesetimbangan kelarutan bisa memiliki dimensi yang berkaitan dengan skala konsentrasi yang telat terukur.
Konstanta kelarutan yang terdefinisikan dalam konsentrasi tersebut tidak hanya bergantung kepada suhu, melainkan juga pada komposisi pelarut apabila terdapat kandungan dan spesies lain, selain berasal dari zat terlarut.
Itulah penjelasan mengenai teori kesetimbangan kelarutan yang menjadi salah satu materi di dalam ilmu kimia. Penting untuk Anda memahami teori kimia satu ini dengan baik agar tidak menambah wawasan di dalam diri. (R10/HR-Online)