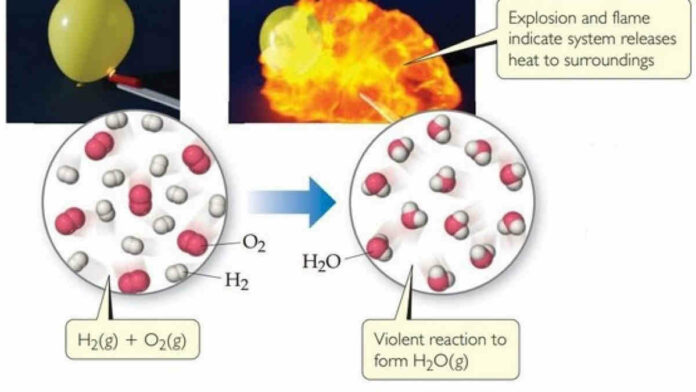
Pengertian entalpi reaksi berada di dalam modul kimia. Materi entalpi reaksi ini berada di termodinamika kimia. Termodinamika kimia tersebut membahas mengenai perubahan energi.
Perubahan dari entalpi akan menyertai suatu reaksi dan akan selalu dipengaruhi oleh suhu serta tekanan. Ketika suhu dari suatu zat semakin tinggi, artinya perubahan entalpi juga akan semakin besar.
Entalpi reaksi merupakan istilah untuk menggambarkan perubahan entalpi yang menyertai reaksi tersebut.
Kita juga dapat memahami entalpi sebagai sejumlah energi pada suatu sistem pada kondisi tekanan yang tetap. Biasanya entalpi akan memiliki lambang huruf kapital H.
Pengertian Entalpi Reaksi dalam Kimia
Ketika mempelajari ilmu kimia, kita akan bertemu dengan materi mengenai termodinamika kimia yang membahas mengenai perubahan energi panas menjadi energi lainnya.
Baca Juga: Pemisahan Campuran Kromatografi, Proses, dan Kegunaannya
Ketika mempelajari ilmu tersebut, maka kita juga akan mengenal rumus entalpi. Ini merupakan sub cabang pembelajaran dari termodinamika tentang jumlah energi, volume, hingga tekanan panas dari suatu zat.
Definisi Entalpi
Entalpi merupakan istilah yang menyatakan banyaknya energi internal, volume, dan bahkan hingga tekanan termal yang ada di dalam suatu zat. Satuan SI untuk entalpi sendiri adalah joule. Ini merupakan bagian dari hukum termodinamika.
Mustahil untuk dapat mengukur entalpi total (H) secara langsung. Dalam mekanika klasik, hanya perubahan dari entalpi lah yang bisa mendapatkan evaluasi.
Entalpi menjadi potensial termodinamika. Oleh karena itu, pengukuran entalpi suatu sistem perlu terlebih dahulu memperhatikan titik acuan, kemudian baru mengukur perubahan entalpi ΔH.
Pengertian entalpi reaksi atau perubahan entalpi positif berperan dalam reaksi endoterm dan yang negatif untuk reaksi eksoterm.
Rumus Entalpi Reaksi (ΔH)
Entalpi sendiri merupakan sifat ekstensif suatu zat yang sangat berguna dalam menentukan perubahan panas di dalam reaksi kimia.
Baca Juga: Senyawa yang Memiliki Ikatan Kovalen Tunggal dan Koordinasi
Nilai dari entalpi sebenarnya tidak dapat kita ukur, tetapi masih dapat mengukur perubahan panas yang terjadi ketika reaksi berlangsung.
Perubahan kalor di dalam kimia tersebut merupakan reaksi entalpi (ΔH). Di dalam tekanan yang konstan, entalpi reaksi yang terjadi akan sama dengan jumlah kalor reaksi yang sistem serap ataupun lepaskan.
ΔH = QP
Entalpi kemudian masih termasuk ke dalam golongan fungsi keadaan. Sehingga penentuan dari perubahan entalpi hanyalah dari keadaan awal dan keadaan akhir sistem.
Alhasil, suatu reaksi kimia dengan reaktan bereaksi akan menghasilkan suatu produk. Berasal dari entalpi reaksi adalah selisih antara entalpi produk dan entalpi reaktan itu sendiri.
Para ahli kimia menjelaskan bahwa suhu 25 derajat Celcius dan tekanan 1 atm menjadi ukuran terbaik entalpi. Lantas, bagaimana sebenarnya rumus entalpi reaksi ini?
Pengertian Entalpi reaksi yang diukur dengan pengukuran standar akan bernama perubahan entalpi standar. Sebagai jumlah energi yang sistem miliki dengan labang U dan kerja memiliki lambang PV sebagai rumus perubahan entalpi adalah H = U + PV.
Penulisan entalpi reaksi di dalam persamaan dapat Anda lakukan dengan memperhatikan pertuan yang ada. Anda perlu menuliskan lambang entalpi reaksi (ΔH) setelah persamaan reaksinya.
ΔH = H(produk) – H(reaktan.
Entalpi Reaksi Standar
Anda sudah memahami apa itu pengertian dari perubahan entalpi hingga rumus hitungnya. Saat ini Anda juga perlu mengetahui jenis-jenis entalpi reaksi standar.
Baca Juga: Contoh Senyawa Alkuna Beserta Manfaatnya di Kehidupan!
Terdapat 6 perubahan entalpi standar. Berikut ini jenis-jenisnya:
- Entalpi pembentukan (∆fH⊖) = entalpi reaksi ketika 1 mol zat terbentuk. Pembentukan ini terjadi atas unsur-unsurnya dan menjadi bentuk yang paling stabil. Dalam keadaan standar, entalpi reaksi pembentukan memiliki notasi ∆H⊖f.
- Jenis entalpi pembakaran = memiliki standar ∆cH⊖ dengan perubahan entalpi tiap mol zat ketika mengalami proses pembakaran.
- Entalpi atomisasi (ΔaH⊖) = merupakan suatu entalpi reaksi yang berupa pemutusan satu mol ikatan dengan sempurna. Ini bertujuan agar bisamendapatkan atom dalam fase gas.
- Jenis entalpi ikatan (ΔbH) = jumlah energi yang lepas ketika mol ikatan mengalami pembentukan dari atom terisolasi ke dalam bentuk gas.
- Entalpi larutan (ΔsolHo) = pengertian entalpi reaksi yang terjadi ketika satu mol zat larut pada pelarut sangat besar, sehingga tidak akan terjadi perubahan panas pada pengenceran lebih lanjut.
- Entalpi kisi (ΔlatticeHo) = adalah suatu istilah entalpi reaksi ketika satu mol senyawa ionic terdisosiasi. Hal tersebut akhirnya akan mengubah ion dalam bentuk gas.
Itulah pengertian entalpi reaksi yang ada di dalam materi kimia, lengkap dengan rumus dan jenis-jenisnya. Entalpi reaksi juga sama dengan perubahan entalpi, jadi Anda tidak perlu bingung ketika mendapati istilah yang berbeda. (R10/HR-Online)