Pengertian konfigurasi elektron adalah sebuah cabang ilmu dalam kimia. Konfigurasi elektron berisi susunan penyebaran elektronnya dalam kulit ataupun orbital sebuah atom.
Elektron satu ini sangat patuh terhadap hukum mekanika kuantum serta memiliki sifat layaknya partikel ataupun gelombang.
Baca Juga: Sejarah Penemuan Elektron, Partikel Subatomik yang Bermuatan Negatif
Pengertian Konfigurasi Elektron
Keberadaan konfigurasi elektron sangat berfungsi untuk berbagai macam hal. Salah satunya adalah untuk mengetahui golongan dan periode dari suatu atom.
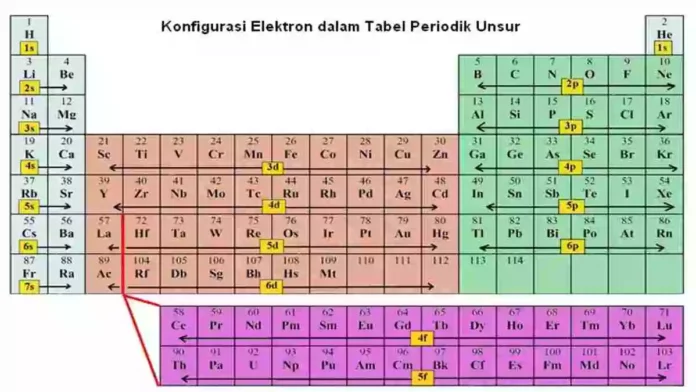
Pada dasarnya, pada ateri ini kamu akan belajar untuk menampilkan jumlah elektron pada setiap sub level.
Sebagai contoh, sub level pertama berawal dengan 1s, maka selanjutnya akan 2s, 2p, 3s dan seterusnya.
Semua elektron di dalam orbital tersebut juga dapat berpindah sendiri. Ada beberapa aturan khusus untuk menentukan konfigurasi elektron.
Prinsip Aufbau
Tokoh yang ada di balik prinsip ini adalah Niels Bohr. Ia merupakan seorang fisikawan asal Denmark.
Bohr menjelaskan bahwa tiap elektron bisa menempati orbital secara bertahap dari subkulit energi yang paling rendah ke lebih tinggi.
Aturan Hand
Friedrich Hund yang merupakan seorang ahli kimia asal Jerman mengemukakan aturan konfigurasi elektron selanjutnya.
Menurutnya, sebuah elektron akan menempati subkulit mereka sendiri-sendiri namun dengan nilai kuantum spin yang sama.
Itu artinya, setiap elektron tidak akan memiliki pasangan sebelum orbital mereka terisi masing-masing satu elektron.
Larangan Pauli
Tokoh lainnya yang ikut menentukan aturan konfigurasi elektron adalah Wolfgang Pauli. Ia berpendapat bahwa di dalam setiap sistem atom atau molekul tidak mungkin ada dua elektron yang memiliki keempat bilangan kuantum (n, I, m, dan s) =sama.
Jika dua elektron menempati orbital sama, maka bilangan kuantum spin dua elektron harus berbeda.
Baca Juga: Pengertian Elektron Valensi, Karakteristik, Serta Penerapannya
Teori Konfigurasi Elektron
Teori Atom Bohr
Pada pengertian konfigurasi elektron, terdapat teori pertama yang disampaikan oleh Niels Bohr.
Teori ini menyebut bahwa setiap lintasan elektron bernama kulit elektron. Jumlah elektron di dalamnya sangat maksimal.
Pengisian elektron dalam teori ini mulai dari tingkat energi (kulit) paling rendah ke paling tinggi. Jumlah maksimal untuk kulit elektron tempati dapat menggunakan rumus 2.n2.
Baca Juga: Perbedaan Proton dan Elektron yang Jelas Bertolak Belakang
Teori Mekanika Kuantum
Dalam teori kedua ini, elektron pada atom akan bergerak mengelilingi inti di kulit atom. Kulit atom meliputi subkulit. Hal ini berisi bilangan kuantum (orbital s, p, d, dan f).
Dalam model mekanika kuantum, penulisan konfigurasi elektron bisa menggunakan diagram orbital yang sudah memiliki aturan penentuan konfigurasi elektron berdasarkan orbitalnya menggunakan lambang kotak.
- 1 kotak untuk subkulit s
- 3 kotak untuk subkulit p
- 5 kotak untuk subkulit d
- 7 kotak untuk subkulit f
Model mekanika kuantum memiliki empat bilangan kuantum. Bilangan tersebut mewakili letak elektron-elektron suatu atom.
Bilangan dalam teori kuantum di pengertian konfigurasi elektron meliputi kuantum utama (n), magnetik (m), spin (s) juga azimuth (I). (R10/HR-Online)