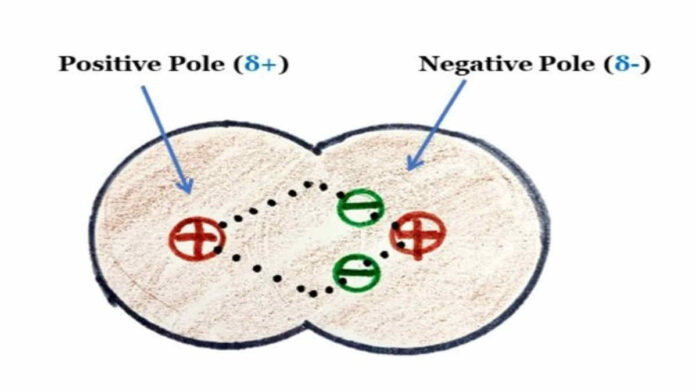
Senyawa kovalen polar atau ikatan kovalen kutub. Senyawa jenis kovalen polar ini merupakan suatu jenis ikatan. Sebagai ikatan kimia, senyawa ini memiliki sepasang elektron yang tidak terbaik dan tidak merata antar keduanya.
Di dalam ilmu kimia, terdapat dua jenis senyawa kovalen, yaitu poplar dan juga non polar. Kovalen polar juga terkenal dengan nama kovalen kutub yang cukup penting.
Senyawa polar merupakan jenis senyawa yang memiliki daerah muatan positif maupun negatif berbeda. Proses tersebut juga terkenal sebagai pengkutuban muatan, yaitu hasil ikatan dengan atom seperti oksigen, nitrogen, atau belerang.
Baca Juga: Simbol Bahan Kimia Berbahaya yang Merugikan, Harus Waspada!
Pengertian Senyawa Kovalen Polar
Pengertian dari ikatan senyawa merupakan hal yang sering berkaitan dengan kehidupan. Salah satunya adalah molekul air atau molekul H2O yang ada di sekitar.
Air ini merupakan contoh dari senyawa polar. Atom oksigen yang ada di dalam molekul air memiliki elektronegativitas lebih besar daripada atom hidrogen yang terlihat secara kovalen.
Hasilnya adalah pergerakan dipon yang membuat ikatan tersebut berbobot positif daripada ujung hydrogen. Senyawa polar ini terbentuk akibat adanya suatu ikatan dengan elektron terhadap unsur-unsurnya.
Pengertian dari ikatan kovalen polar adalah jenis ikatan kimia yang sepasang elektronnya terbagi secara tidak merata antara dua jenis atom. Di dalam ikatan kovalen polar, elektron tidaklah terbagi sama sebab atom telah menghabiskan lebih banyak waktu bersama elektron ketimbang atom lainnya.
Pada ikatan senyawa kovalen polar suatu atom akan memiliki tarikan lebih kuat daripada jenis atom yang lainnya serta menarik elektron.
Senyawa Ikatan Kovalen Polar Apa Saja?
Elektron pada dasarnya memiliki muatan negatif, sehingga menghabiskan lebih banyak waktu dengan atom akan membuat atom tersebut ikut membawa muatan negatif parsial.
Baca Juga: Pengertian Senyawa Alkana, Ciri, Deret Homolog & Contohnya
Sementarra itu, atom yang tidak menghabiskan waktu bersama elektron bakal membawa muatan positif parsial. Agar lebih mudah, Anda dapat menggambarkan senyawa kovalen kutub sebagai ikatan penarik dan satu atom memiliki tarikan lebih banyak terhadap elektron daripada jenis atom lainnya.
Sebenarnya kita sudah tergantung dengan jenis ikatan kovalen ini sehari-harinya. Salah satu contoh senyawa kovalen polar adalah air minum yang mengandung atom H2O.
Kita dapat menyebut senyawa atom atau ikatan atom tersebut sebagai ikatan kovalen kutub. Elektron ini akan terbagi secara tidak seimbang bahkan waktunya juga lebih banyak dengan elektron jika dibandingkan dengan hidrogen.
Itu terjadi karena elektron telah menghabiskan waktu lebih banyak dengan atom elektron daripada atom hidrogen. Alhasil, atom oksigen akan membawa muatan negatif parsial.
Ciri-Ciri Ikatan Kovalen Polar
Agar lebih memahaminya dan tidak salah pengertian, ada beberapa ciri-ciri senyawa kovalen kutub yang perlu Anda pahami. Berikut ciri-cirinya:
- Kovalen polar atau kutub memiliki ikatan yang lebih mudah untuk larut di dalam air. Senyawa ini bahkan bisa menjadi pelarut jenis polar lainnya.
- Senyawa kovalen kutub memiliki dua jenis kutub berbeda, yaitu kutub positif dan juga kutub negatif. Ini terjadi karena adanya pendistribusian secara tidak seimbang atau tidak merata pada kandungan elektron di dalamnya.
- Pasangan elektron di dalam senyawa kovalen kutub secara bebas atau juga memiliki perbedaan dalam hal keelektronegatifan.
- Atom klor di dalam ikatan senyawa kovalen kutub akan menghabiskan lebih banyak waktu dengan elektron daripada atom hidrogen, sehingga membawa muatan negatif parsial. Sedangkan atom hidrogen bermuatan positif parsial.
Baca Juga: Senyawa Non Polar: Pengertian, Ciri-Ciri, dan Contohnya
Sifat-Sifat Senyawa Polar
Senyawa kovalen kutub memiliki sifat tersendiri. Sifat ini membedakannya dengan ikatan senyawa non polar.
Ada sejumlah sifat dari senyawa kovalen kutub, antara lainnya adalah banyak memperlihatkan dari titik leleh yang rendah. Apabila pada suhu ruangan, maka ikatan senyawa ini akan berbentuk gas atau cairan.
Lalu, senyawa kovalen polar juga larut di dalam pelarut non polar dan juga sedikit di dalam air, mudah terbakar, banyak yang memiliki bau, dan juga sedikit menghantarkan muatan listrik.
Secara umum, kesimpulan yang bisa Anda dapatkan adalah senyawa polar dapat berperan menjadi senyawa polar lainnya.
Itulah alasan kenapa air bisa melarutkan beberapa senyawa kovalen polar, begitu juga sebaliknya. Di sisi lain, air tidak akan bisa melarutkan senyawa non polar lainnya. Jadi, ini merupakan salah satu sifat utama senyawa polar. (R10/HR-Online)